Struttura
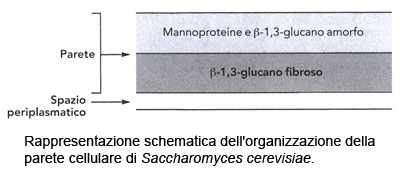
La parete del lievito è formata da due componenti principali: i β-glucani e le mannoproteine. La chitina è presente in minor misura.

I lavori più dettagliati sulla parete dei lieviti sono stati realizzati su Saccharomyces cerevisiae, il principale lievito responsabile della fermentazione alcolica del mosto d’uva.
Le mannoproteine, costituite da mannosio legato a delle proteine, costituiscono dal 25 al 50% della parete di S. cerevisiae. Le mannoproteine di S. cerevisiae hanno pesi molecolari compresi tra 20.000 ed oltre 450.000 Da. Esse possiedono gradi di glicosilazione variabili, ma alcune di loro, contenenti circa il 90% di mannosio e il 10% di peptidi, sono polimannosilate. Sono state descritte quattro forme di glicosilazione, ma non si trovano necessariamente tutte insieme in tutte le mannoproteine.
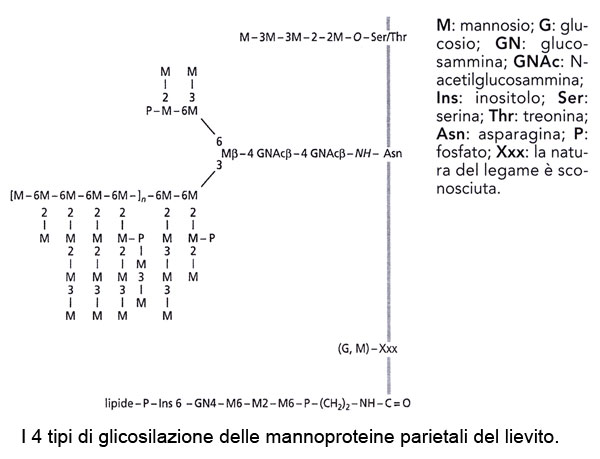
Il mannosio delle mannoproteine può formare corte catene lineari, da 1 a 5 residui, legate alla catena peptidica con legami O-glicosilici sui residui di serina e treonina.
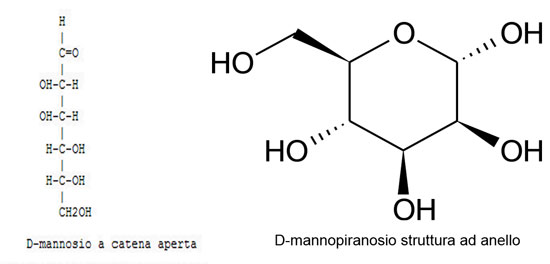
I legami glicosidici di queste catene laterali sono del tipo a-1,2 e a-1,3. La parte glucidica delle mannoproteine può essere anche un polisaccaride, legato ad un residuo di asparagina della catena peptidica con un legame N-glicosilico, facendo intervenire una doppia unità di N-acetil-glucosammina (o chitobiosio) legata in β-1,4. Il mannano così legato all’asparagina è formato da una regione d’unione, costituita da una decina di residui di mannosio e da una catena periferica o esterna, altamente ramificata, di 150-250 unità di mannosio. La regione d’unione contiene, oltre al residuo di chitobiosio, uno scheletro di mannosio legato in α-1,6, con dei rami laterali che possiedono 1, 2 o 3 residui di mannosio uniti da legami α-1,2 e/o α-1,3. Anche la catena esterna è formata da uno scheletro di unità di mannosio legate in α-1,6, che porta corte catene laterali, costituite da residui di mannosio legati in α-1,2 e da un mannosio terminale in α-1,3. Alcuni di questi rami laterali portano loro stessi una ramificazione attraverso un legame fosfodiestere.
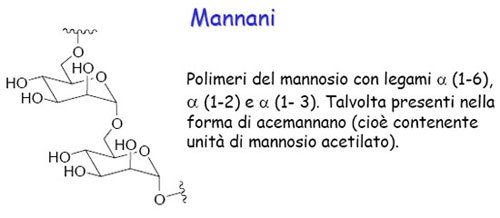
Un terzo tipo di glicosilazione, che può intervenire nelle mannoproteine parietali del lievito, è stato descritto di recente. Si tratta di una catena di glucomannano che contiene essenzialmente residui di mannosio legati in α-1,6 e residui di glucosio legati in α-1,6. Resta da precisare la natura del punto di unione glucano-peptide, ma potrebbe trattarsi di legami asparaginil-glucosio. Inoltre, siccome questo tipo di glicosilazione caratterizza alcune proteine liberate dalla parete per azione della β-1,3 glucanasi, si può ipotizzare che in vivo la catena di glucomannano contenga anche residui di glucosio legati in β-1,3. Il quarto tipo di glicosilazione delle mannoproteine del lievito è l’ancoraggio glicosil-fosfatidil-inositolo (GPI). Questo legame, tra la parte carbossilica terminale della catena peptidica e un fosfolipide della membrana, permette a certe mannoproteine, che attraversano la parete, di essere ancorate alla membrana plasmatica. La regione d’unione contiene la seguente sequenza caratteristica: etanolammina-fosfato-6-mannosio-α-1,2-mannosio-α-1,6-mannosio-α-1,4-glucosammina-α-1,6-inosi tol-fosfolipide.
La presenza di tale ancora in certe mannoproteine non significa che queste rimangano legate alla membrana. Le mannoproteine possono staccarsi per rottura enzimatica del fosfolipide. Una fosfolipasi C, specifica per il fosfatidilinositolo, quindi capace di realizzare questa rottura, è stata messa in evidenza in S. cerevisiae . Anche diverse mannoproteine ad ancoraggio GPI sono state identificate nella parete di S. cerevisiae.
I lieviti sono la seconda maggior fonte di polisaccaridi del vino. Un mezzo sintetico contenente zuccheri, inizialmente impoverito di colloidi, inoculato con S. cerevisiae, si arricchisce di colloidi nel corso della sua fermentazione; questo arricchimento prosegue, dopo la fermentazione alcolica per tutto il tempo in cui il mezzo fermentato è conservato sulla biomassa del lievito e può raggiungere diverse centinaia di mg/L. La quantità di polisaccaridi ceduti dal lievito dipende dal ceppo e dalle condizioni di fermentazione e di conservazione ed è tanto più elevata quanto più alta è la temperatura, l’agitazione del mezzo e il tempo di conservazione sulla biomassa.
Nel caso della vinificazione dei vini bianchi secchi, i polisaccaridi sono liberati soprattutto nel corso dell’affinamento sui lieviti, rimessi in sospensione con regolarità; il fenomeno è lento in quanto la temperatura di conservazione è bassa (da 12 a 16 °C). Invece, l’arricchimento dei vini rossi in colloidi dei lieviti avviene essenzialmente nel corso della macerazione postfermentativa alla temperatura di 30-35 °C, ma è limitato in quanto la maggior parte dei lieviti viene separata dal vino al momento della svinatura.
La struttura molecolare delle mannoproteine esocellulari del lievito complessivamente è simile a quella delle mannoproteine localizzate nella parete. Essa comprende una catena peptidica, a cui sono legate da una parte delle corte catene costituite da una a quattro unità di mannosio, dall’altra un a-D mannano ramificato di alto peso molecolare.
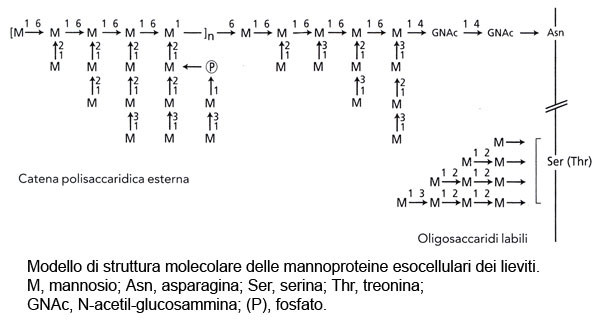
I legami degli oligosaccaridi sono del tipo α-(1,2) e α-(1,3); queste molecole sono innestate sui residui di serina e di treonina del peptide con legami O-glicosidici che possono essere rotti per idrolisi alcalina blanda (β-eliminazione), con liberazione di mannosio, mannobiosio, mannotriosio e mannotetrosio. La maggior parte delle mannoproteine è liberata durante la fermentazione per escrezione, in quanto non utilizzata per la costruzione delle pareti. La liberazione dei polisaccaridi dei lieviti deriva anche dalle attività enzimatiche parietali del lievito: endo-β-(1,3)- ed endo-β-(1,6)-glucanasi che sono attive durante la fermentazione alcolica e si mantengono ad un livello più debole nei diversi mesi che seguono la morte delle cellule. L’autolisi parietale che deriva da questo processo porta alla liberazione di mannoproteine ancorate sul glucano parietale e ad una idrolisi parziale della frazione gluco-mannoproteica. Le attività glucanasiche spiegano anche la diminuzione della proporzione del glucosio nei polisaccaridi dei lieviti isolati dai mezzi fermentati conservati su biomassa.
Azioni sul vino
Molti lavori di ricerca hanno dimostrato come le mannoproteine derivanti dal lievito siano la classe di polisaccaridi in grado di interagire più efficacemente con altre molecole del vino, apportando sensibili miglioramenti organolettici e qualitativi, a patto che si trovino in forma libera e non più legate ai glucani parietali. L’arricchimento del vino in polisaccaridi, ed in particolare in manno-proteine, avviene “naturalmente” nel corso della fermentazione alcolica e durante il processo di autolisi del lievito. L’interesse verso queste molecole è legato al duplice effetto che esse sono in grado di svolgere: effetto colloide ed effetto organolettico.
Considerata l’importanza dell’azione svolta dalle mannoproteine, molti lavori hanno cercato di stabilire quali fossero i parametri in grado di influenzare la loro produzione ed il loro rilascio nel mezzo.
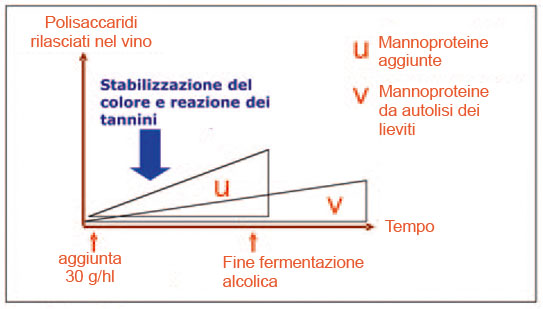
Tali studi hanno stabilito che la quantità di mannoproteine prodotte e rilasciate in fermentazione è un carattere genetico che varia da ceppo a ceppo di lievito e che, inoltre, il rilascio di tali polisaccaridi è influenzato dalla fase di sviluppo del lievito e dalle condizioni di fermentazione. Analogamente a quanto accade in fermentazione, anche la liberazione di mannoproteine durante l’autolisi dei lieviti è un carattere legato al ceppo. Le mannoproteine più «protettrici» sono estratte dalle pareti dei lieviti nel corso della conservazione «sur lies»; esse possono anche essere preparate su scala industriale per digestione delle pareti con un preparato a base di β-glucanasi (Glucanex), secondo un processo brevettato.
Altrettanto indagate sono le proprietà delle diverse frazioni di mannoproteine nei confronti del vino:
• interazione positiva con gli aromi, in quanto la frazione proteica delle MP si lega alle sostanze aromatiche stabilizzandole; il risultato pratico è che diminuisce la volatilità di alcuni composti, con una leggera diminuzione di intensità olfattiva, accompagnata però da una conservazione molto più prolungata degli aromi nel tempo;
• miglioramento della qualità del perlage;
• miglioramento della stabilità proteica, per effetto stabilizzante di una particolare frazione di mannoproteine (MP32) nei confronti delle proteine termoinstabili dell’uva;
• miglioramento della stabilità tartarica: in tale caso l’azione delle MP non è ancora ben chiara, anche se l’ipotesi più plausibile prevede che esse funzionino da colloidi protettori, in grado di inibire la formazione dei nuclei di gemmazione dei cristalli di tartrati;

• adsorbimento ed allontanamento dei tioli maleodoranti;
• influenza sulla “corposità” di un vino;
• interazione con i tannini, attenuando le sensazioni di astringenza ed amplificando le sensazioni di volume;
• interazioni con tannini ed antociani, prevenendone la precipitazione e contribuendo a stabilizzare il colore, le mannoproteine avvolgono gli aggregati di tannini all’interno di una struttura colloidale stabile nel vino;
• influenza positiva sulla fermentazione malolattica: l’associazione delle mannoproteine con i tannini pare in grado di diminuire l’effetto antisettico dei questi ultimi nei confronti dei batteri malolattici.

Esistono in commercio preparati di manoproteine estratte da cellule intere o da pareti isolate con metodi chimici o enzimatici. I metodi chimici utilizzano il trattamento in autoclave con alcali o con tampone citrato a pH 7. I metodi enzimatici liberano le mannoproteine per digestione dei glucani. Sono meno denaturanti per la struttura delle mannoproteine rispetto ai metodi chimici. La preparazione enzimatica più correntemente utilizzata per estrarre le mannoproteine parietali di S. ccrevisiae è la zimoliasi ottenuta da un batterio (Arthrobacter luteus). L’efficacia di questo complesso enzimatico si deve essenzialmente alla sua attività β-1,3 glucanasica, ma non si può escludere che qualche attività proteasica contaminante la zimoliasi possa concorrere alla liberazione delle mannoproteine. Un’altra preparazione industriale di β-glucanasi (Glucanex), prodotta da un fungo (Trichoderma harzianum) ed avente attività endo- ed eso-β-1,3-glucanasica ed endo-β-1,6-glucanasica, permette di estrarre facilmente le mannoproteine dalla parete delle cellule di S. cerevisíae.
L’impiego di mannoproteine del lievito, siano esse derivanti direttamente dall’azione del ceppo in fermentazione o dall’impiego di prodotti biotecnologici, costituiscono uno strumento fondamentale per preservare “naturalmente” la qualità dei vini, migliorando proprio quelle caratteristiche di aroma, colore, volume e morbidezza che costituiscono i tratti distintivi nell’enologia moderna.
Derivati di lievito: nuovo strumento nell’affinamento dei vini
IMPIEGO DI CARBOSSIMETILCELLULOSA IN ENOLOGIA
BIBLIOGRAFIA
GAROGLIO P. G. (1980). Nuova Enologia – Enciclopedia vitivinicola mondiale. Ed. AEB.
GILDO DAL CIN (1982) ELABORAZIONE E STABILIZZAZIONE DEI VINI Ed. Dal Cin
MARGALIT Y. (2005). Elementi di chimica del vino. Ed.Eno-One
PEYNAUD E., BLOUIN J. (2002). Scienza e elaborazione del vino. Ed. Eno-One
RIBEREAU-GAYON P., DUBOURDIEU D., DONECHE B., LONVAUD A. (2000). Handbook of Enology, voi. I. Ed. John Wiley & Sons, LTD.
VIVAS N. e coll. (2003). Prodotti di Tatttamento ed Ausiliari di Elaborazione dei Mosti e dei Vini. Ed.
Eno-One
